L’INTERIEUR D’UN ATOME
XIXème siècle :
|
Le comportement de la matière selon son état physique a mené les scientifiques à imaginer le modèle de la molécule. Ce modèle de molécule a été aussi perfectionné de manière à interpréter les transformations chimiques. Au cours de celles-ci, les molécules changent, mais la masse totale se conserve, signe que les molécules sont composées d’atomes qui se séparent et se réorganisent autrement pour former de nouvelles molécules. |
Antoine Laurent de Lavoisier (1743-1844) |
John Dalton (1766-1844) |
Amédéo Avogadro (1776-1856) |
|
Parmi les scientifiques investis dans ce travail, on peut citer Antoine Laurent de Lavoisier, John Dalton et Amédéo Avogadro |
|||
fin XIXème et début du XXème siècles : |
Jean Perrin (1870-1942) |
|
|
Joseph John Thomson (1856-1950) |
Plus tard, Joseph John Thomson et Jean Perrin étudient le comportement de décharges électriques (tels que les éclairs). Leurs expériences montrent qu’il s’agit de particules chargées électriquement. Elles ont une charge négative et seront appelées électron. Preuve était faite que l’atome n’était pas en fait le plus petit grain de matière possible, car eux-mêmes possédaient tous des électrons. L’atome a un diamètre de l’ordre de 10-10 m et n’est pas chargé. Par conséquent, il devait contenir « quelque chose » de positif pour compenser la charge négative des électrons. |
|
|
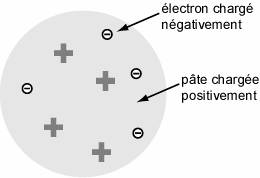
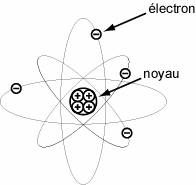
A ce stade, deux modèles s’opposent. JJ Thomson imagine l’atome comme un pudding : une pâte positive parsemée de raisins (les électrons) négatifs ; Jean Perrin, quant à lui, imagine un modèle planétaire, c’est-à-dire des électrons qui gravitent autour d’un noyau central positif. Quelques années plus tard, Ernest Rutherford fit une découverte capitale : en bombardant une mince feuille d’or avec des particules, il observa que la plupart des particules traversaient la feuille sans être déviées ! Il montra ainsi l’existence du vide au sein même de l’atome ! Le modèle correct était donc le modèle planétaire et le diamètre du noyau était de l’ordre de 10-15 m. Questions : |
Ernest Rutherford (1871-1937) |
|
1) Schématiser les deux modèles imaginés par JJ Thomson et Jean Perrin. Inscrivez des légendes.
2) Lequel de ces deux modèles a été retenu ensuite ?
3) Sur le modèle planétaire, qu’y a-t-il entre le noyau et les électrons ?
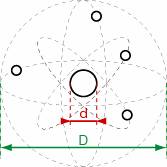
4) Calculer le rapport entre le diamètre de l’atome et celui du noyau. Quel commentaire peut-on faire ?
5) Quelle est la charge d’un atome ? Qu’en a-t-on déduit nécessairement ?
6) Quelles particules sont responsables de la circulation d’un courant électrique dans un solide ?
Réponses :
…………………………………………………………………………………………………………………………………..
…………………………………………………………………………………………………………………………………..
…………………………………………………………………………………………………………………………………..
…………………………………………………………………………………………………………………………………..
…………………………………………………………………………………………………………………………………..
|
Modèle de JJ Thomson : |
Modèle de Jean Perrin : |
L’INTERIEUR D’UN ATOME
Correction
Réponses :
1)
|
Modèle de JJ Thomson : le pudding
|
Modèle de Jean Perrin : le modèle planétaire
|
|
2) Le modèle retenu aujourd’hui est le modèle planétaire. 3) Entre le noyau central et les électrons, il y a du vide. 4) Le diamètre de l’atome est de l’ordre de D = 10-10 m. Le diamètre du noyau est de l’ordre de d = 10-15 m. Le rapport entre les deux est égal à : D / d = 10-10 / 10-15 = 105 = 100 000 Le noyau est 100 000 fois plus petit que l’atome. Ce rapport est comparable à celui d’une tête d’épingle au centre d’un terrain de foot. La matière est donc constituée essentiellement de vide ! |
|
5) La charge d’un atome est nulle, il est neutre. Par conséquent, la charge positive du noyau compense la charge négative des électrons.
6) Les particules responsables de la circulation du courant électrique dans un solide sont les électrons.